Коррозия металлов. все виды особенности и факты
Содержание:
Фосфатирование и хроматирование
Металлическую поверхность следует правильно подготовить к процессу защиты. То, какие методы будут использоваться, полностью зависит от типа поверхности. Например, черные металлы защищают при помощи фосфатирования. Цветные металлы можно обрабатывать обоими методами. В целом, если говорить о химической подготовке, необходимо уточнить, что она проходит в несколько этапов. Для начала поверхность обезжиривается. Затем промывается при помощи воды. Далее наносится конверсионный слой. После повторно промывается двумя типами воды: питьевой и деминерализованной соответственно. Далее осталось провести пассивацию. Химическую обработку следует проводить при помощи распыления, погружения, а также пароструйного и гидроструйного методов. Первые два способа необходимо применять при помощи специальных агрегатов, которые полностью подготовят поверхность к работе. То, какой метод выбрать, необходимо решать зависимости от размеров, конфигурации изделия и так далее. Для того чтобы лучше разобраться в этом вопросе, следует знать уравнения реакций коррозии металлов.
Показатель скорости коррозии
Для установления скорости коррозии металла в данной среде обычно ведут наблюдения за изменением во времени какой-либо характеристики, объективно отражающей изменение свойства металла. Чаще всего в коррозионной практике используют следующие показатели.
Показатель изменения массы
Показатель изменения массы – изменение массы образца в результате коррозии, отнесенное к единице поверхности металла S и к единице времени (например, г/м ч).
В зависимости от условий коррозии различают:
1. отрицательный показатель изменения массы
К-m=
где m – убыль массы металла за время коррозии после удаления продуктов коррозии.
2. положительный показатель изменения массы К+m=
где m – увеличение массы металла за время вследствие роста пленки продуктов коррозии.
Если состав продуктов коррозии известен, то можно сделать пересчет от К к К и наоборот К-m= К+m (nok A Me / n Me Aok)
где А и М – атомная и молекулярная масса Ме и окислителя соответственно; n и n валентность металла и окислителя в окислительной среде.
Объемный показатель коррозии
К – объем поглощенного или выделившегося в процессе газа V отнесенный к единице поверхности металла и единице времени (например, см/см ч).
К= об. V / s
объем газа обычно приводят к нормальным условиям.
Применительно к электрохимической коррозии когда процесс катодной деполяризации осуществляется за счет разряда ионов водорода, например, по схеме 2Н + 2е = Н, или ионизация молекул кислорода О + 4е +2НО = 4ОН; вводятся соответственно кислородный (К) и водородный (К ) показатель соответственно.
Водородный показатель коррозии – это объем выделившегося Н в процессе коррозии, отнесенный к Su.
Кислородный показатель коррозии – это объем поглощенного в процессе О, отнесенный к Su.
Показатель сопротивления
Изменение электрического сопротивления образца металла за определенное время испытаний также может быть использован в качестве показания коррозии (К).
КR = (R/Ro) 100% за время t
где Ro и R – электрическое сопротивление образца соответственно до и после коррозии.
У этого способа есть некоторый недостаток толщина металла во все время испытаний должна быть одинаковой и по этой причине чаще всего определяют удельное сопротивление, т.е. изменение электрического сопротивления на единицу площади образца (см, мм) при длине равной единице. Этот метод имеет ограничения применения (для листового металла не более 3мм). Наиболее точные данные получают для проволочных образцов. Этот метод не пригоден для сварных соединений.
Механический показатель коррозии
Изменение какого-либо свойства металла за время коррозии. Сравнительно часто пользуются изменением предела прочности. Прочностной показатель при этом выражается:
Кo = (в/во) 100% за время t
где в – изменение предела прочности при растяжении после коррозии образца в течение времени; во – предел прочности до коррозии.
Глубинный показатель коррозии
К – глубина разрушения металла П в единицу времени (например, мм/год).
Глубина коррозионного разрушения П может быть средней или максимальной. Глубинный показатель коррозии можно использовать для характеристики как равномерной, так и неравномерной коррозии (в том числе и местной) металлов. Он удобен для сравнения скорости коррозии металла с различными плотностями. Переход от массового, токового и объемного к глубинному возможен при равномерной коррозии.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.
Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.
Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.
Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
Схема гальванического элемента
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
Стальной болт — медная гайка (корродирует сталь)
А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде
2H + +2e — = H2разряд водородных ионов
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Оцинкование в подробностях
Мы уже с вами рассмотрели основные виды коррозии, а сейчас хотелось бы поговорить о лучших методах защиты. Одним из таких является оцинкование. Суть его заключается в том, что на обрабатываемую поверхность наносится цинк или его сплав, что придает поверхности некоторые физико-химические свойства. Стоит отметить, что данный метод считается одним из самых экономичных и эффективных, и это при том, что на металлизацию цинком расходуется примерно 40 процентов от мировой добычи этого элемента. Оцинкованию могут подвергаться стальные листы, крепежные детали, а также приборы и другие металлоконструкции. Интересно то, что с помощью металлизации или распыления можно защитить изделие любого размера и формы. Декоративного назначения цинк не имеет, хотя с помощью некоторых специальных добавок появляется возможность получения блестящих поверхностей. В принципе, этот металл способен обеспечить максимальную защиту в агрессивных средах.
Электрохимическая коррозия и ее особенности
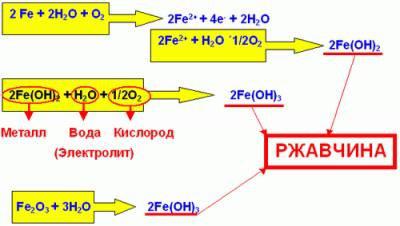
При электрохимической коррозии разрушение материала происходит из-за его прикосновения к электролиту. В качестве последнего вещества может быть конденсат, дождевая вода. Нужно заметить, что чем больше будет солей в жидкости, тем выше показатель электропроводности. Соответственно, процесс коррозии будет протекать довольно быстро. Если говорить о наиболее популярных местах, которые поддаются коррозии, нужно отметить заклепки в металлической конструкции, сварные соединения, а также просто места, в которых материал поврежден. Бывает так, что сплав железа при его создании покрыт специальными веществами, которые имеют антикоррозионные свойства. Однако это не предотвращает процесс ржавения, а лишь его замедляет. Довольно ярким примером можно назвать оцинковку. Цинк имеет отрицательный потенциал, если сравнивать с железом. Из-за этого последний материал будет восстанавливаться, а цинк повредится. Если на поверхности будет находиться оксидная пленка, то процесс разрушения станет длительным. Электрохимическая коррозия имеет несколько видов, но нужно отметить, что все они опасные и, как правило, остановить такой вид коррозии металлов невозможно.
Смесь «Уризол»
Смесь “Уризол” следует рассмотреть отдельно, так как ее используют для покрытия трубопровода. Также она подойдет для фитингов, соединительных деталей, крановых узлов и тех изделий, которые постоянно контактируют с нефтью или газами. Данный состав нужен для того, чтобы избавиться от влияния подземных и атмосферных воздействий. Нередко данная смесь также применяется для изоляции бетонных материалов. Данное вещество наносится очень просто, без какого-либо труда. Для того чтобы обработать поверхность, необходимо использовать распылитель. Только так можно избежать коррозии металлов и сплавов подобных изделий. Как только компоненты соединяются, начинается реакция. Из-за этого возникает полимочевина. После этого смесь переходит в гелеобразное и нетекучее состояние, а после некоторого времени становится твердой. Если скорость полимеризации будет медленной, то начнут образовываться подтеки. Они вредные, так как из-за них трудно наращивать толщину покрытия. Нужно заметить, что эта смесь долгое время сохраняет липкое состояние. За счет этого все слои будут максимально равномерными, а промежуточные замеры толщины сравняются между собой. Если процесс полимеризации будет слишком быстрым, то адгезия состава уменьшится. При этом толщина получаемого слоя для изоляции будет неравномерной. К слову, распылительный пистолет быстро засоряется, если скорость покрытия слишком быстрая. Факторы коррозии металлов не будут появляться, если сделать все верно. Для того чтобы предупредить подобные ситуации, необходимо тщательно подбирать компоненты и соблюдать правила изготовления.
Виды коррозии бетона
Хрупкость бетона может вызываться одним из трех видов коррозии. Довольно нередко встречается изменение структуры данного материала. Рассмотрим же, из-за чего это происходит.
Наиболее распространенным видом коррозии следует назвать разрушение цементного камня. Как правило, это происходит тогда, когда жидкость и атмосферные осадки постоянно воздействуют на материал. Из-за этого структура материала разрушается. Ниже есть более подробные примеры коррозии металлов:
- Взаимодействие с кислотами. Если цементный камень будет постоянно под воздействием данных материалов, то образуется довольно агрессивный элемент, который вреден для покрытия. Речь идет о бикарбонате кальция.
- Кристаллизация труднорастворимых веществ. Здесь речь идет о коррозии. Из-за того что грибки, споры и другие вещества попадают в поры, бетонное покрытие начинает быстро разрушаться.
Особенности защитных средств от ржавчины
При работе с металлом любой человек понимает, что перед тем как наносить защитные материалы, необходимо подготовить поверхность. Зачастую все трудности заключаются именно в этом этапе. Для того чтобы создать специальный барьер, который позволит ржавчине добираться до металла, необходимо ввести понятие компаунда. Благодаря ему в комплекте сформируется защита от коррозии. При этом имеет место электроизоляция. Обычно довольно сложно защищаться от коррозии черных металлов.
Из-за специфики использования различных средств для защиты необходимо понимать условия эксплуатации материала. Если металл будет располагаться под землей, то необходимо использовать многослойные покрытия, которые будут иметь не только антикоррозионные свойства, но и усиленную защиту от механических повреждений. Если речь идет о коммуникациях, которые активно взаимодействуют с кислородом и газами, следует использовать средство, минимизирующее воздействие воды и кислорода
Соответственно, повышенное внимание со стороны производителя будет уделяться изоляции от влаги, пара и низких температур. В таком случае следует добавлять присадки и специальные пластификаторы, ведь причины коррозии металлов различны и защищаться следует от всех видов
Газовая коррозия
Самая частая разновидность химической коррозии — газовая — представляет собой коррозийный процесс, происходящий в газах при повышенных температурах. Указанная проблема характерна для работы многих типов технологического оборудования и деталей (арматуры печей, двигателей, турбин и т.д.). Кроме того, сверхвысокие температуры используются при обработке металлов под высоким давлением (нагревание перед прокаткой, штамповкой, ковкой, термическими процессами и т.д.).
Особенности состояния металлов при повышенных температурах обуславливаются двумя их свойствами — жаропрочностью и жаростойкостью. Жаропрочность — это степень устойчивости механических свойств металла при сверхвысоких температурах. Под устойчивостью механических свойств понимается сохранение прочности в течение продолжительного времени и сопротивляемость ползучести. Жаростойкость — это устойчивость металла к коррозионной активности газов в условиях повышенных температур.
Скорость развития газовой коррозии обуславливается рядом показателей, в числе которых:
- температура атмосферы,
- компоненты, входящие в металл или сплав,
- параметры среды, где находятся газы,
- продолжительность контактирования с газовой средой,
- свойства коррозийных продуктов.
На коррозийный процесс больше влияние оказывают свойства и параметры оксидной пленки, появившейся на металлической поверхности. Образование окисла можно хронологически разделить на два этапа:
- адсорбция кислородных молекул на металлической поверхности, взаимодействующей с атмосферой,
- контактирование металлической поверхности с газом, в результате чего возникает химическое соединение.
Первый этап характеризуется появлением ионной связи, как следствие взаимодействия кислорода и поверхностных атомов, когда кислородный атом отбирает пару электроном у металла. Возникшая связь отличается исключительной силой — она больше, нежели связь кислорода с металлом в окисле.
Объяснение такой связи кроется в действии атомного поля на кислород. Как только поверхность металла наполняется окислителем (а это происходит очень быстро), в условиях низких температур, благодаря силе Ван-дер-Ваальса, начинается адсорбция окислительных молекул. Результат реакции — возникновение тончайшей мономолекулярной пленки, которая с течением времени становится толще, что усложняет доступ кислорода.
На втором этапе происходит химическая реакция, в ходе которой окислительный элемент среды отбирает у металла валентные электроны. Химическая коррозия — конечный результат реакции.
Указанные выше методики подразделяются на две группы:
- Повышение химической сопротивляемости и изолирование применяются до того, как металлоконструкция запускается в эксплуатацию.
- Уменьшение агрессивности среды и электрохимическая защита используются уже в процессе применения изделия из металла. Применение этих двух методик дает возможность внедрять новые способы защиты, в результате которых защита обеспечивается изменением эксплуатационных условий.
Один из самых часто применяемых способов защиты металла — гальваническое антикоррозийное покрытие — экономически нерентабелен при значительных площадях поверхностей. Причина в высоких затратах на подготовительный процесс.
Ведущее место среди способов защиты занимает покрытие металлов лакокрасочными материалами. Популярность такого метода борьбы с коррозией обусловлена совокупностью нескольких факторов:
- высокие защитные свойства (гидрофобность, отталкивание жидкостей, невысокие газопроницаемость и паропроницаемость),
- технологичность,
- широкие возможности для декоративных решений,
- ремонтопригодность,
- экономическая оправданность.
В то же время, использование широкодоступных материалов не лишено недостатков:
- неполное увлажнение металлической поверхности,
- нарушенное сцепление покрытия с основным металлом, что ведет к скапливанию электролита под антикоррозийным покрытием и, таким образом, способствует коррозии,
- пористость, приводящая к повышенной влагопроницаемости.
И все же, окрашенная поверхность защищает металл от коррозийных процессов даже при фрагментарном повреждении пленки, тогда как несовершенные гальванические покрытия способны даже ускорять коррозию.
Виды коррозийных процессов
Коррозия металлов имеет большое количество разновидностей. Но в основном все виды подразделяются на два основных типа:
- Коррозия общего характера. Она называется равномерной, а встречается чаще всего. Причиной возникновения такой коррозии считаются химические и электрохимические реакции. Такая разновидность коррозии приводит к отрицательному воздействию на всю поверхность материала и металлической конструкции. При этом процесс может быть равномерным или неравномерным. При неравномерном распределении ржавчины, она на одном участке разъедает материала быстрее и сильнее, чем на соседнем.
- Местный вид коррозии. Возникает на одном участке, где и развивается.
- Местная пятнами. Возникает на отдельных участках материала.
- Язвенная, ее еще называют питтинг.
- Межкристаллитная — такая коррозия возникает на пограничных областях металлического кристалла. Чаще вспыхивает в тех материалах, которые содержат в составе никель и алюминий. Металл в кратчайшие сроки остается без первоначальных показателей прочности и эластичности.
- Растрескивающая.
- Подповерхностная.
- Коррозия под током — возникает под воздействием блуждающего или постоянного тока.
- Коррозийная кавитация — вариант разрушений, когда помимо ржавчины на металл воздействует и ударная сила.
- Фреттинг-коррозия — одновременное воздействие ржавчины и вибрации, которые совместно приводят к разрушению металлических конструкций. варианты.
Есть еще различия и по механизму воздействия.
См.также: Самые дорогие металлы в мире
Химический вариант разрушения
Это разновидность процесса, при котором рушатся связи металлические, а между атомами веществ материала и окислителей возникает химическая взаимодействие. В такой ситуации не образуется электрический ток между различными областями материала. В свою очередь такой вид разрушения подразделяется еще на два типа:
- Газовый вариант. Получается при воздействии агрессивных азов, а также паров в сочетании с высокими показателями температуры. Если материал относится к активным, то воздействие таких сред может привести к окончательному разрушению материала по всей поверхности. К таким средам относятся: сероводород, диоксид серы, пары воды, кислород. Такой вид разрушительного процесса чаще всего заметен в промышленности и на химическом производстве.
- Жидкостный вариант ржавчины. Случается в неэлектролитических веществах. Если имеется даже небольшое содержание жидкости, то процесс становится электрохимическим.
Важно, что при химической разновидности коррозии металл разрушается со скоростью протекания химической реакции. См.также: Обработка металла давлением
См.также: Обработка металла давлением
Электрохимическая ржавчина
Этот вариант разрушительных процессов возникает в среде электролитов. Процесс сочетается с возникновением тока. В итоге из решетки вещества убирается атом и одновременно протекают два процесса:
- Анодный — вещество материала в качестве ионов входит в раствор.
- Катодный — те вещества, которые получаются в предыдущем процессе, связываются при помощи деполяризатора.
Собственно отвод электродов так и называется — деполяризация, а непосредственно вещества, которые способствуют данному процессу именуются деполяризаторами.
Наиболее часто возможно встретить вариант разрушения с водородной и кислородной деполяризацией.